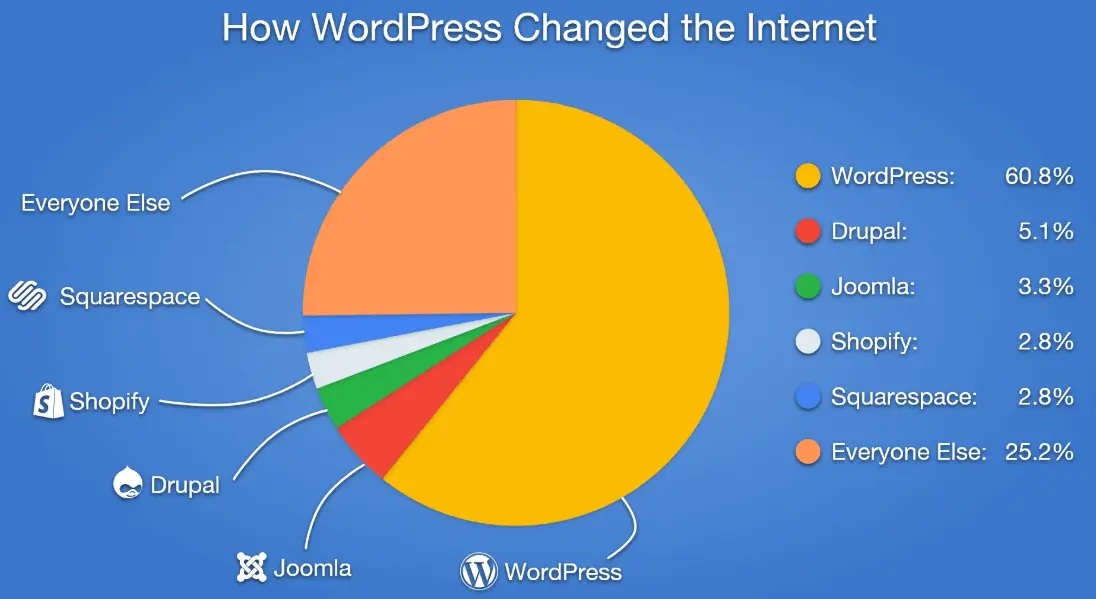
Илону Маску запрещено внедрять чипы в мозг

Регулирующие органы США отклонили предложение Илона Маска протестировать мозговые чипы на людях, сославшись на риски для безопасности. С 2019 года Илон Маск не менее четырех раз предсказывал, что его компания по производству медицинских устройств Neuralink вскоре начнет испытания на людях революционного мозгового импланта для лечения трудноизлечимых состояний, таких как паралич и слепота. Тем не менее компания, основанная в 2016 году, не обращалась за разрешением в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) до начала 2022 года, и агентство отклонило заявку, сообщили Reuters семь нынешних и бывших сотрудников.
Об отказе ранее не сообщалось. Объясняя свое решение Neuralink, агентство обозначило десятки проблем, которые компания должна решить перед тестированием на людях, что является важной вехой на пути к одобрению конечного продукта, говорят сотрудники. Основные опасения агентства касались литиевой батареи устройства; вероятность того, что крошечные провода имплантата мигрируют в другие области мозга; и вопросы о том, можно ли и как удалить устройство, не повреждая мозговую ткань, сказали сотрудники.

Спустя год после отказа Neuralink все еще работает над проблемами агентства. Трое сотрудников заявили, что они скептически относятся к тому, что компания сможет быстро решить проблемы, несмотря на последний прогноз Маска на презентации 30 ноября о том, что этой весной компания получит одобрение FDA на испытания на людях.
Neuralink не раскрыла подробности своей пробной заявки, отказа FDA или степени беспокойства агентства. Как частная компания, она не обязана раскрывать информацию о таких нормативных взаимодействиях инвесторам. Во время многочасовой ноябрьской презентации Маск сказал, что компания представила в агентство «большую часть наших документов», не указав никаких формальных заявлений, а официальные лица Neuralink признали, что FDA задавало вопросы безопасности в том, что они охарактеризовали как продолжающийся разговор.
Маск и другие официальные лица Neuralink не ответили на просьбы прокомментировать устройство компании или ее отношения с FDA. Агентство отказалось комментировать Neuralink, сославшись на законы, охраняющие конфиденциальность коммерческой информации.
Источники Neuralink отказались предоставить Reuters письменный отказ агентства, который является юридически конфиденциальным документом. Сотрудники, в том числе четверо, прочитавшие документ FDA, и другие, осведомленные об опасениях агентства, рассказали о проблемах безопасности в интервью на условиях анонимности. Такие отказы FDA не означают, что компания в конечном итоге не сможет получить одобрение агентства на проведение испытаний на людях. Но отказ агентства сигнализирует о серьезных опасениях, по мнению более дюжины экспертов по процессам утверждения устройств FDA.